dynamics

タンパク質などの生体分子は、その構造を動的に変化させることで機能を発揮します。私たちは、原子分解能で定量的な動的構造情報を得ることのできるNMR法の強みを生かし、生物学的に重要なタンパク質の構造-機能相関を明らかにしてきました。また、リガンドや標的分子の運動性を積極的に創薬に活用する「動的構造創薬」を推進しています。NMR法によって明らかになる構造・運動性情報は、好ましい結合特性を持つリガンドの開発や、中分子などの新しい創薬モダリティの利用の促進にも繋がります。
多剤結合タンパク質の動的薬剤認識

多剤耐性はすべての生物界に広く保存された最も基本的な防御機能ですが、病原性細菌やがんにおいては、薬剤治療の大きな障害となります。しかし、多剤結合タンパク質が、どのようにして多様な分子に高い親和性で結合し、その機能を発揮できるのかは不明でした。
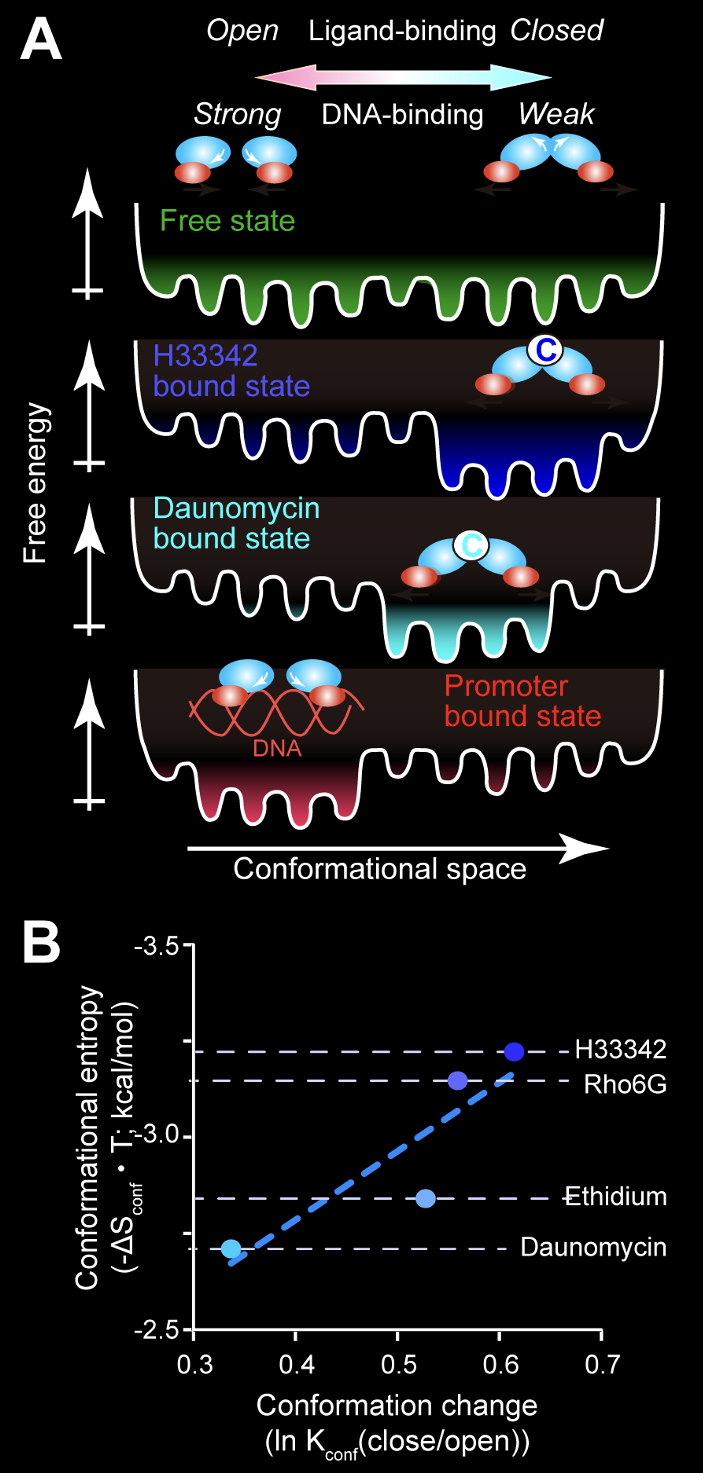
当研究室におけるNMR法による解析の結果、多剤結合転写因子の一種であるLmrRは、化合物を結合しない状態では化合物に結合するヘリックスの角度が様々に変化した多様な構造間の平衡にある一方、結合時にはその多様な構造から化合物に合った構造が選択されることで、様々な薬剤に結合できることがわかりました(Panel A, Sci. Rep., 2014; Sci. Rep., 2017)。その際、LmrRは、結合部位から離れた領域で運動性を増大させ、自由エネルギーの損失を構造エントロピーの増大により回避し、高い親和性を実現していました(Panel B)。
また病原性細菌である黄色ブドウ球菌由来のQacRは、化合物の大きさに応じて転写活性を示す構造の割合が変化し、転写活性化度が変化することも明らかになりました(Proc. Natl. Acad. Sci. USA, 2019)。このようにダイナミックな多剤耐性の分子メカニズムは、タンパク質の運動性をありのままに解析可能なNMR法により初めて明らかとなったものです。
GPCRの動的活性化機構

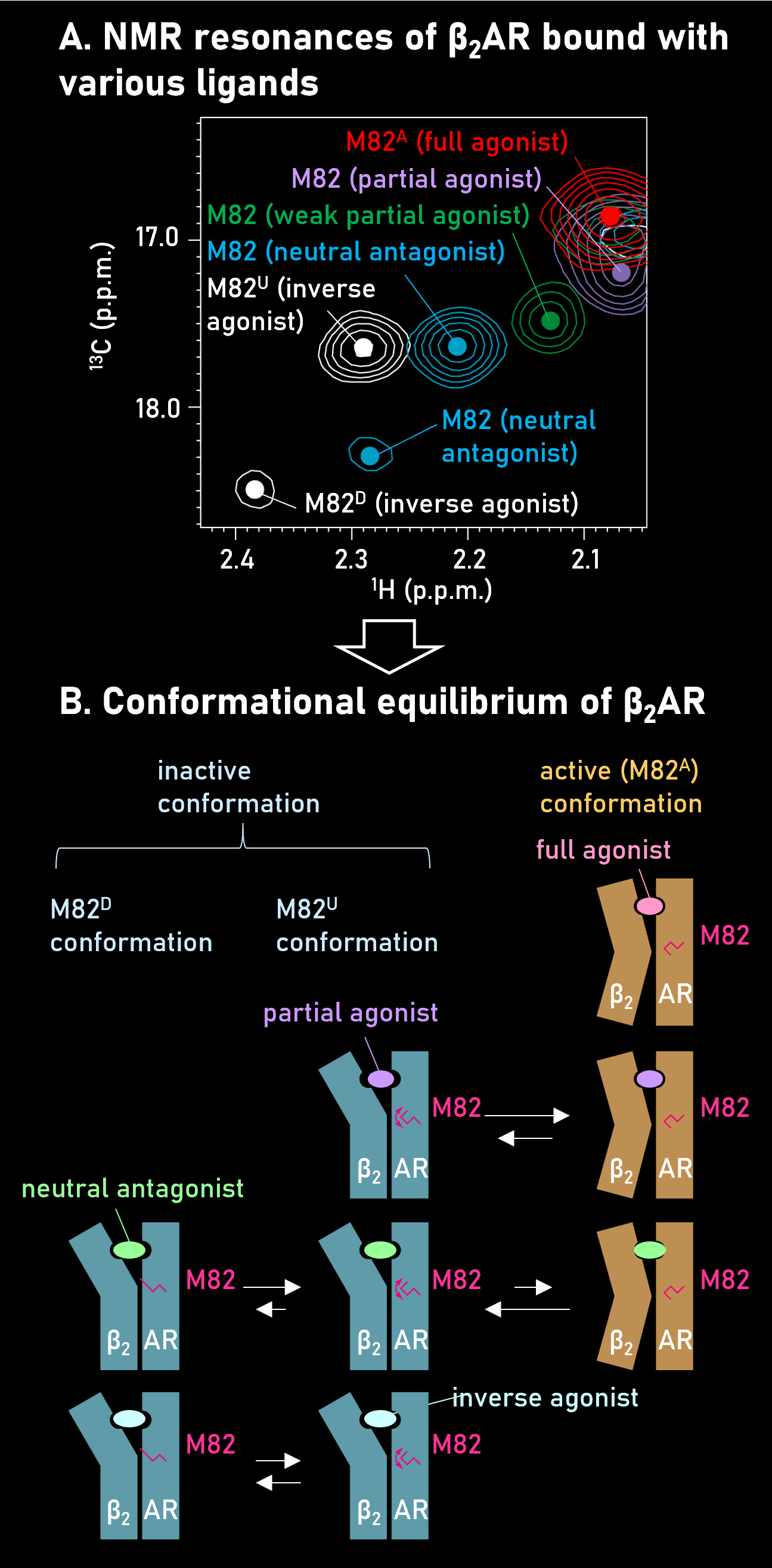
Gタンパク質共役型受容体(GPCR)は、真核生物における代表的な膜タンパク質であり、神経伝達物質・ホルモンなど様々な外部刺激に対する細胞応答を誘起します。また、市販薬のおよそ3分の1はGPCRを標的としており、医薬品の標的分子としても重要です。GPCRはリガンドの結合により、細胞内のシグナル伝達経路を活性化します。この活性化の程度は薬効度とよばれますが、リガンドによって薬効度が大きく異なるメカニズムは不明でした。私たちは、GPCRの一種であるβ2アドレナリン受容体(β2AR)について、NMR法を用いた解析を行い、膜貫通領域に由来するシグナルが、リガンドの薬効度に依存して連続的な化学シフト変化を示すことを見出しました (Panel A)。このことにより、β2ARには、活性型・不活性型構造間の平衡が存在すること、その平衡の偏り度合いがリガンドの薬効度を規定することを、はじめて示しました(Panel B, Nat. Commun., 2012)。
また、GPCRのシグナル伝達には、Gタンパク質とアレスチンを介した2種類の経路が存在しますが、このシグナル経路のバランスについても、膜貫通領域の動的性質が関わることを明らかにしました(Angew. Chem. Int. Ed., 2015)。NMR法を用いて、GPCRの機能が発揮されるメカニズムを解析することは、GPCRを標的とした創薬にもつながります。
NMR解析に基づくシグナル伝達モデルの構築

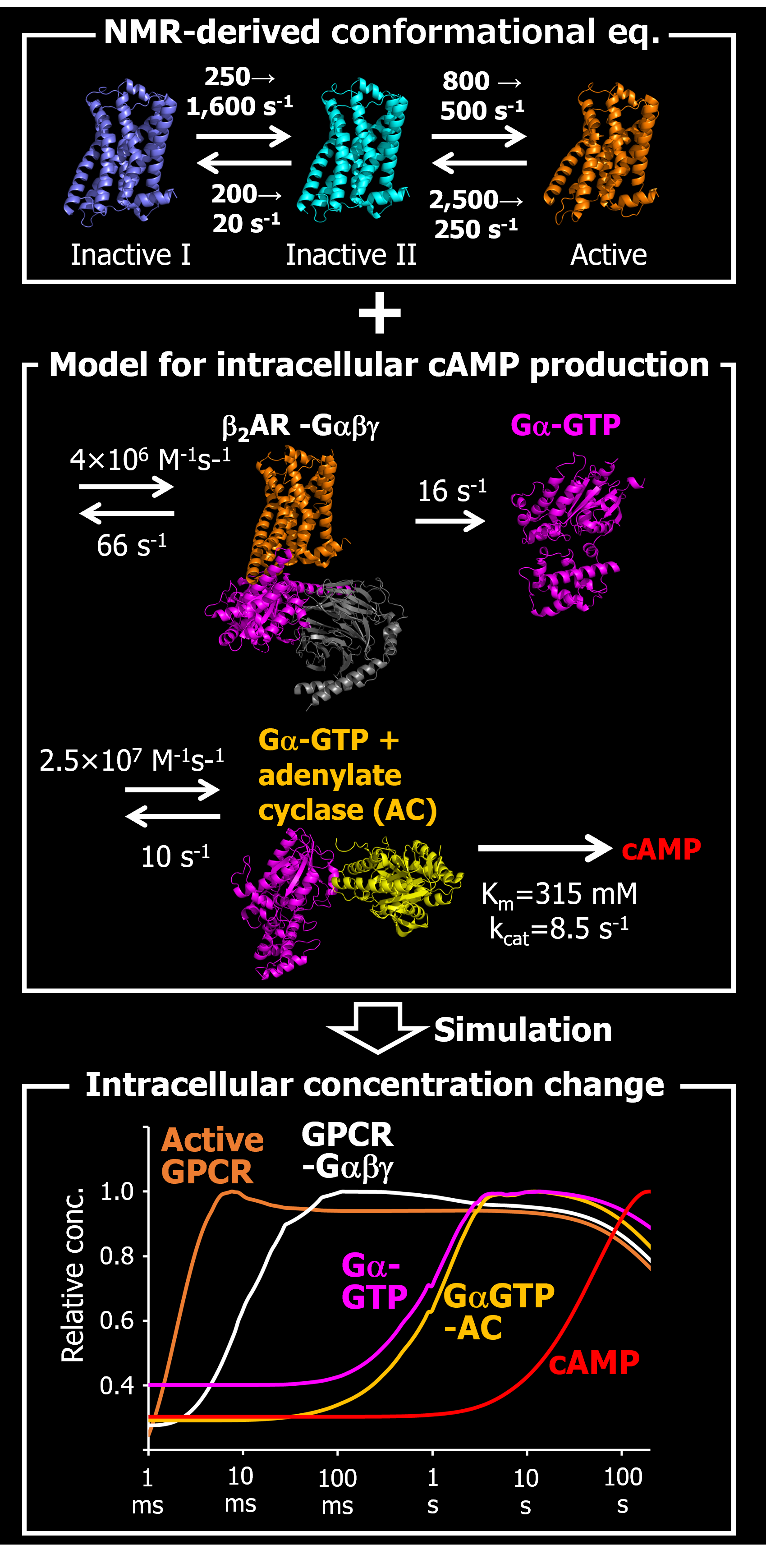
生体内では、多数のタンパク質がその立体構造をたえず変化させながら協奏的に機能することで、様々な生理現象を担っています。受容体タンパク質への薬物の結合は、動的構造の変化を伴ってその活性を摂動し、タンパク質ネットワーク全体に協奏的な機能変化を生じさせます。したがって、生命現象を理解し、薬効を制御する指針を立てる上では、原子から細胞まで多階層にわたる実験データを取得し、生命現象を統合的に説明するモデルを構築する必要があります。また、ネットワークを制御するには、ネットワークの挙動を制御している要素の特定が重要になります。
私達は、NMR法によりGPCR等の活性を規定する構造平衡を明らかにした上で、細胞レベルの研究から構築された数理モデルと統合することで、シグナル伝達速度や温度感受特性を解明してきました(Angew. Chem. Int. Ed., 2014; Sci. Rep., 2017)。複雑なモデルを構築すると、計算量が急激に増大することがボトルネックとなりますが、私達は、機械学習の分野において、多数のパラメータを網羅的かつ効率的に探索することが知られている交換モンテカルロ法を用いることで、その問題を解決することに成功しています (Sci. Rep., 2017; Nat. Chem. Biol., 2020)。今後、これらの研究をさらに発展させて、様々な生命現象の解明と薬効メカニズムの理解を通した創薬の加速を目指します。
動的な創薬作用点の発見と活用

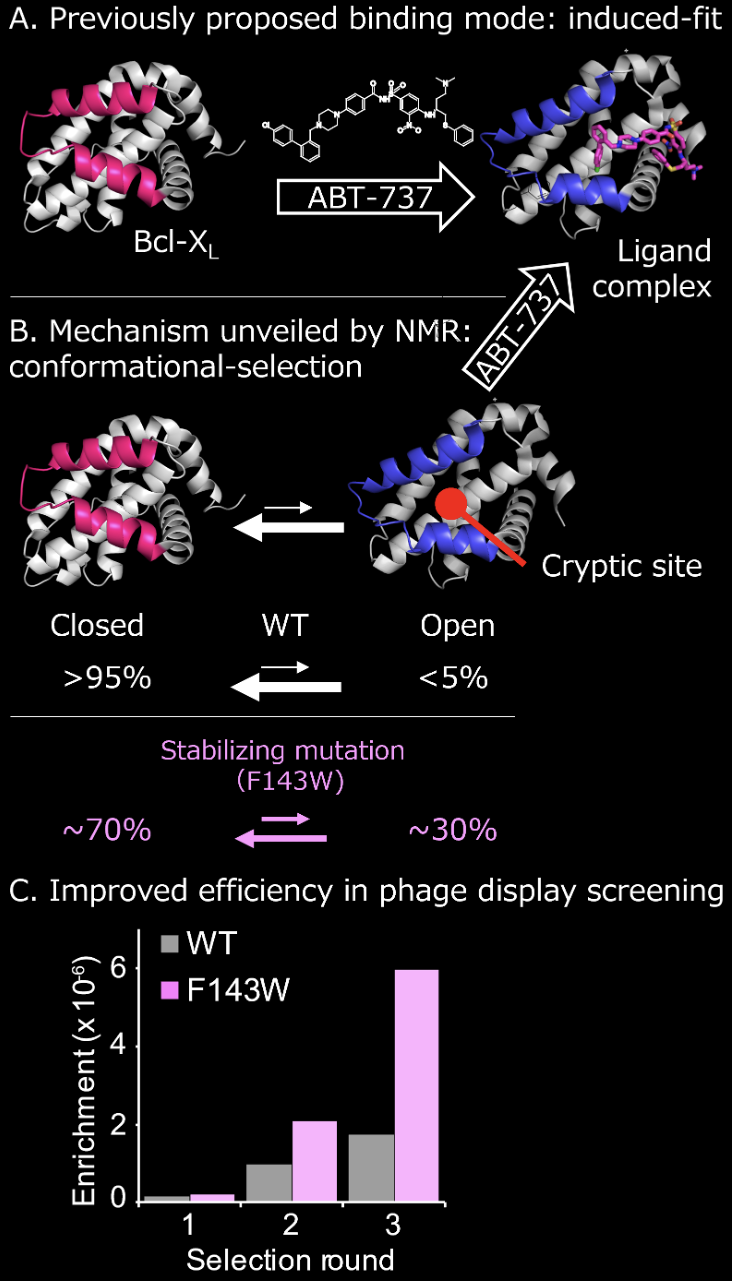
タンパク質-タンパク質相互作用 (PPI) は、多くの魅力的な創薬標的を含んでいます。 しかしながら、PPIサイトは一般的に平面的で広いため、低分子リガンドによりカバー することが困難で、PPI標的創薬は容易ではありません。一方、いくつかのPPI阻害剤は、 リガンドがないときには顕わでなく、リガンドが結合すると形成されるように見える動的な 創薬作用点:クリプトサイトに結合することが知られています。クリプトサイトは、 これまでリガンドと標的との複合体構造が決定されて、初めて見出されてきましたが (Panel A)、クリプトサイトをリガンドがない状態であらかじめ発見し、活用することができれば、 PPI阻害剤を含め難しい標的に対する薬剤の構築を効率化できるはずです。
私たちはPPI阻害剤の標的となるタンパク質Bcl-xLに、リガンドが結合していない状態でも、 僅かな割合ではあるもののクリプトサイトが開いた構造が存在することを、NMRを用いた 運動性解析により見出しました (Panel B)。また、NMR情報をもとに、同定したクリプトサイトを リガンドなしでも安定に開いた状態で保持させる変異体を構築することで、Bcl-xLに対する ヒット探索を効率化することに成功しました (Panel C)。このことは、NMR法を用いた構造平衡の 制御により、PPIやタンパク質のドラッガビリティを改善できることを示しています。 (Sci. Adv., 2019)