methods
私たちは、NMR法の可能性を拡げる方法論の開発を行うことで、これまでアプローチすることの難しかった高分子量タンパク質の機能メカニズムの解明や変異体に頼らない構造-機能相関解析の確立、細胞内創薬への展開などを可能にする研究を行っています。我々の開発する多様な基盤技術は、NMR法によって明らかになる構造・ダイナミクス情報にさらなる付加価値を与え、その利用を促進します。
異種核検出NMR技術

100kDaを超える高分子量領域における溶液NMRの適用はいまだに難しさがあります。その主な要因は、分子量依存的な横緩和の加速によるNMR情報の損失です。現在、検出核として最も広く使用されている水素核(1H)は、固有の感度は高いものの、高分子量領域における横緩和の加速が、 他の核種と比べて大きいことが知られています。
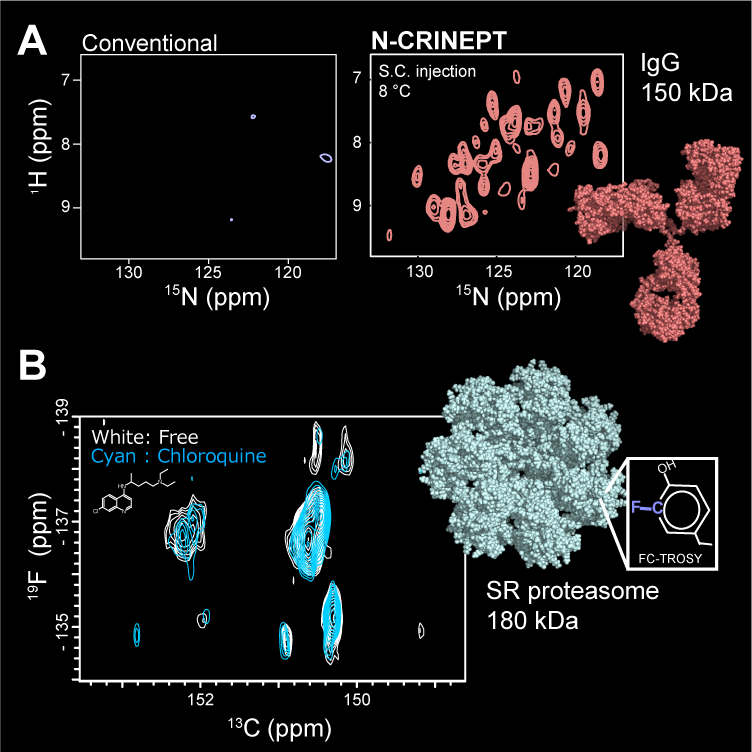
そこで私たちは、100kDa以上の高分子量領域で適用可能な異種核検出NMR実験を開発しました ( Rec. Dev. Biomol. NMR, 2012; eMagRes, 2017)。この手法では、検出に13C、15Nなどの異種核を使用します。これらの核は、固有の感度は1Hよりも低いものの、特に重水素化されていない・できない系において、その遅い緩和特性により、1Hよりも優れた検出感度を示します。最新の例としてはN-CRINPT(J. Med. Chem., 2020)やFC-TROSY(Nat. Methods., 2019)があり、N-CRINEPTは、実効分子量として300 kDaにもなる低温・保存温度において、抗体医薬アナログの構造的特徴を明らかにしました(Panel A)。また、FC-TROSYにより、180kDaの20Sプロテアソームα7リングの芳香族側鎖NMRシグナルが得られています(Panel B)。 FC-TROSYは、in-cell NMR法においても、他の生体分子由来のバックグラウンドが無い、良質なNMRスペクトルを取得できると期待されます。
テラヘルツNMR

タンパク質の機能を人為的に操作できれば、生物学的研究や病気の治療にも有用です。 しかし、そのための方法は、特異的リガンド、化学修飾、遺伝子操作などに限られていました。 一方、テラヘルツ(THz)付近の電磁波は、タンパク質の機能に関連した振動モードと共鳴すれば タンパク質の機能を調節できる可能性があるため、このような状況を大きく変えうると考えています。
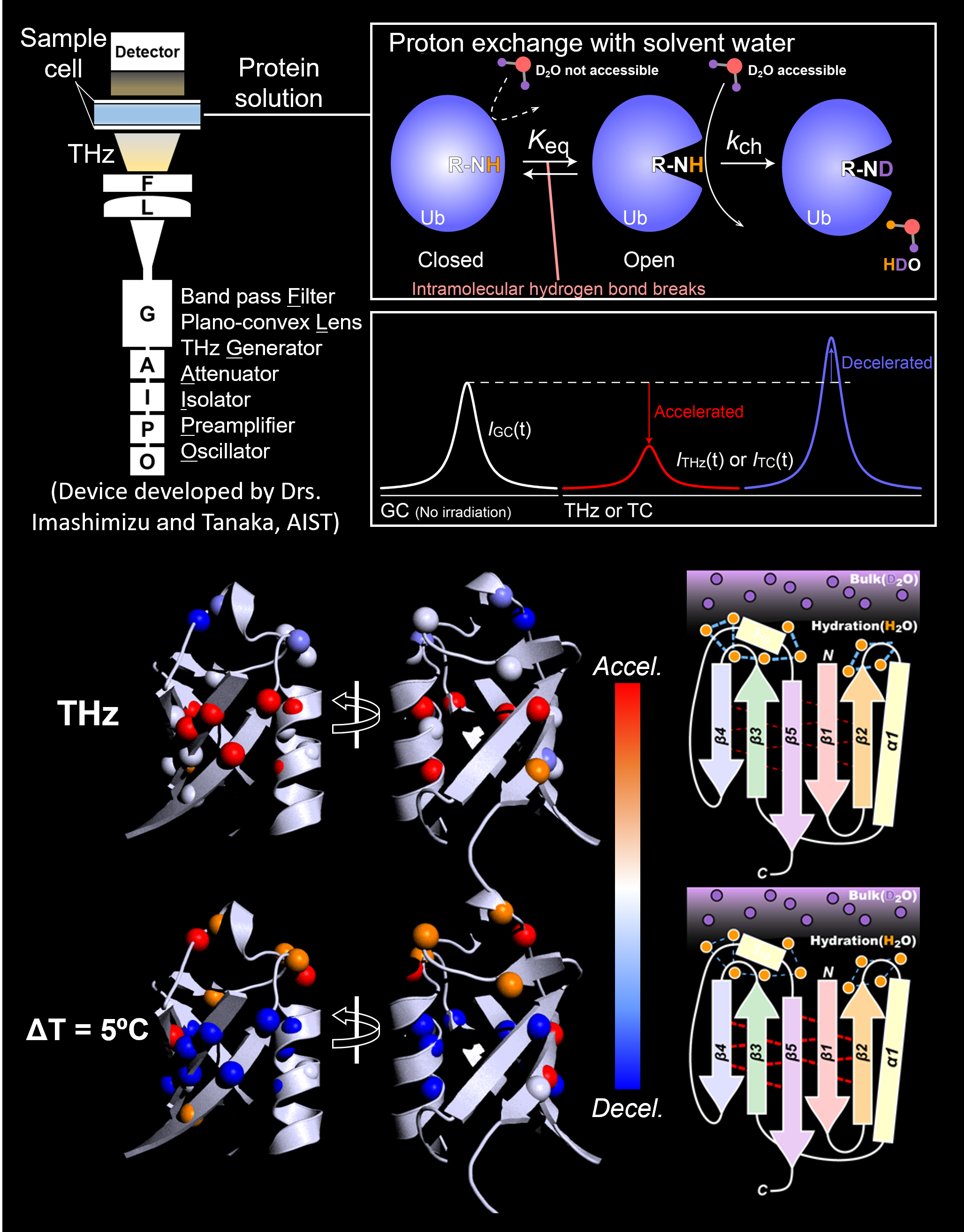
その実用化のためには、テラヘルツ波の照射がタンパク質に影響を及ぼすメカニズムについて、 理解を深めることが必要です。本研究室では、テラヘルツ波の照射によって誘起されるタンパク質 構造の運動性の変化をアミノ酸残基ごとに観測する実験スキームを開発しました。我々は、 テラヘルツ波の照射による一過性で可逆的な構造変化を、溶媒水とのプロトン交換効率の変化として NMR シグナル強度に写し取る方法を考案しました。この方法を用い、テラヘルツ照射の熱的な影響を 排除するための厳密な対象実験を実施することにより、タンパク質表面の水和に対するテラヘルツ波 照射の非熱的な影響を捉えることに成功しています(Biophys J., 2021)。
現在、より高い時空間分解能の達成を目指して実験法を改良するとともに、 テラヘルツ波照射による構造変化が機能に与える影響についても研究しています。
安定同位体標識

NMR法を用いたタンパク質の動的構造解析においては、2H、 13C、15Nなどの安定同位体を適切な位置に導入することで、観測したい場所を選んで解析することができます。特に、観測したい原子の周囲を高度に2H標識することで、TROSY法などの測定法と組み合わせた高感度NMR解析が可能になります。
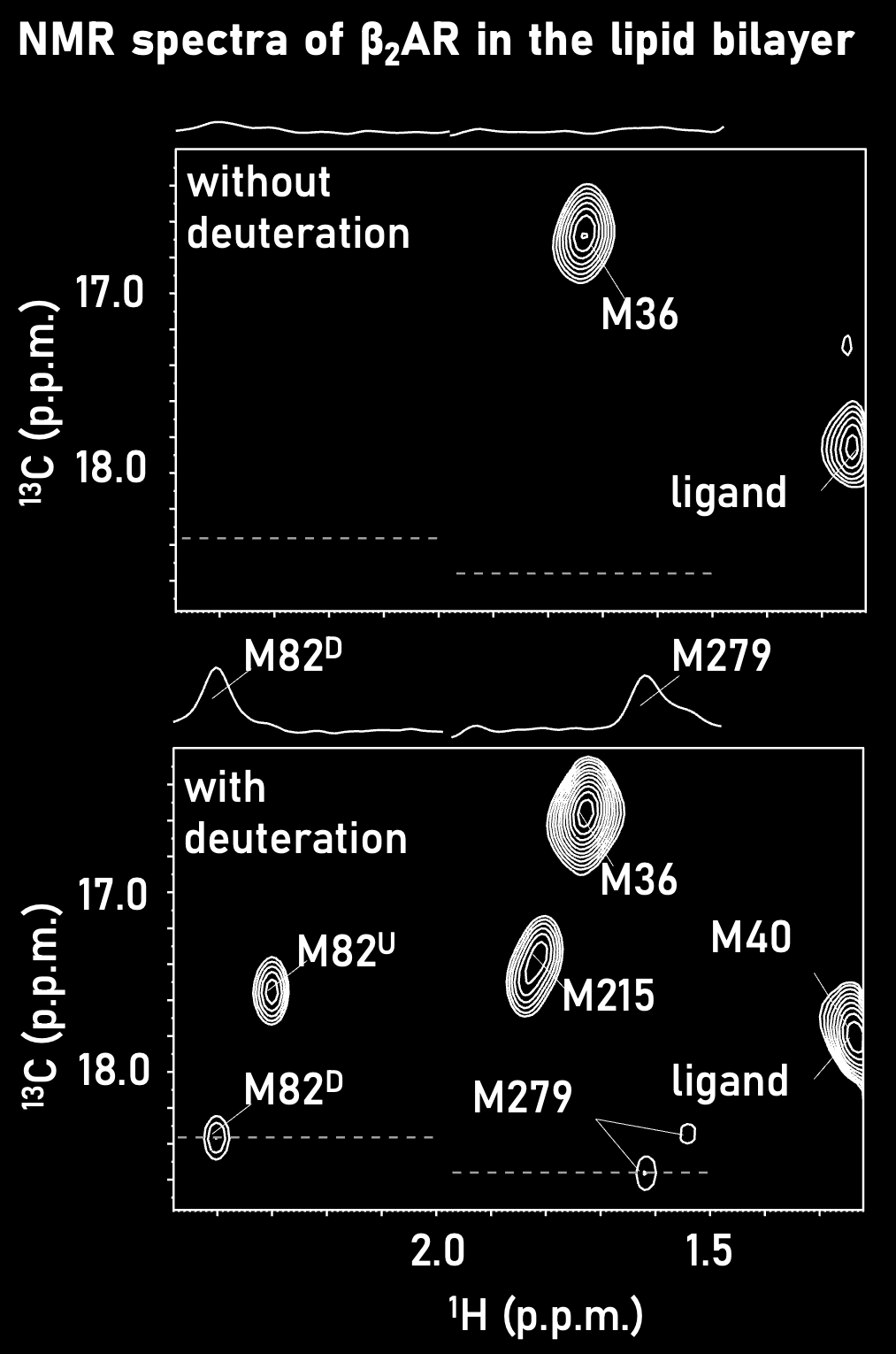
このような安定同位体標識技術は、主に大腸菌を用いたタンパク質調製において発展してきましたが、真核細胞である昆虫細胞や哺乳細胞に単純に適用することは困難であり、特に、これらの細胞は重水(D2O)中で生育しないことから、高度な2H標識をおこなうことが困難であると考えられていました。 私たちは、昆虫細胞を用いたGPCRをはじめとする膜タンパク質の発現において、メチル基を選択的に13C標識し、その周囲に存在するアミノ酸残基を高度に2H標識する技術を開発してきました。これにより、NMR測定感度の5倍以上の向上を達成し、脂質二重膜中に再構成したGPCRの溶液NMR解析にはじめて成功しました(Angew. Chem. Int. Ed., 2014)。この手法を適用することで、脂質二重膜中のリガンド依存性イオンチャネルの動作機構の解明にもつながりました(Proc. Natl. Acad. Sci. USA., 2016)。
以上のような新規安定同位体標識法の開発により、重要な創薬標的分子ではあるが、これまで解析がされてこなかった、高分子量タンパク質や真核生物の膜タンパク質のNMR解析を推進できるようになると期待されます。
細胞内構造創薬

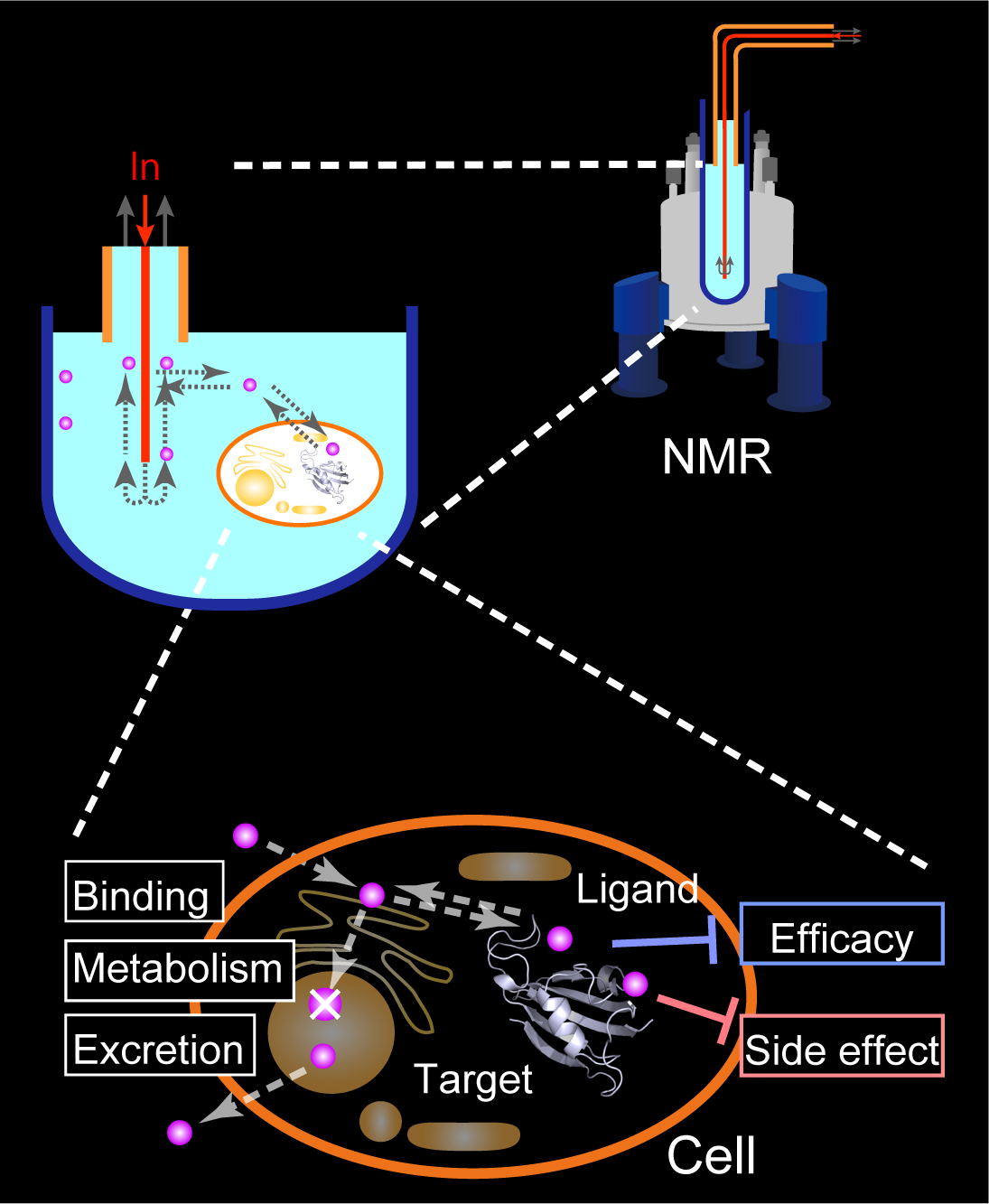
創薬は、多くの場合、精製された標的に対して結合を示す化合物の探索から始まります。 その後、活性を向上させたり、薬剤に必要とされる動態や毒性など様々な要素を評価・ 改善することで、長い年月をかけて化合物は磨き上げられます。しかし、異なる条件から 得られる情報を統合し、薬剤設計を推進することはたやすいことではありません。特に、 試験管内と細胞内という決定的な環境の差異は、時に想定外の結果を招き、 創薬開発の効率を低下させる一つの要因になっていると考えられます。
私たちは、NMRを用いて、生きた細胞内で創薬を行う細胞内創薬を実現し、 創薬プロセスを進めるために必要となる多くの情報を、細胞内条件で同時に取得する、 “新たな薬づくりの方法”を実現できないかと考えています。そのために、私たちが これまで作り上げてきたNMR測定技術や動的構造解析技術を細胞内に持ち込むだけでなく、 メタボノミクス解析などにも広い守備範囲を持つNMR法の特徴を活用することで、 薬剤に対する細胞応答や薬剤暴露下の細胞毒性をも同時解析する必要があります。 薬剤の構造最適化や薬効評価、動態評価、毒性評価などを同一条件で推進できる 細胞内創薬技術の開発は、創薬科学の発展に大きく貢献できるものと考えています。