interaction
タンパク質などの生体分子は、様々な分子が共存する不均一な環境である細胞内において、相互作用する相手をダイナミックに変化させながら機能を発揮します。私たちは、不均一な系においても原子分解能で相互作用を解析できるNMR法の強みを生かし、生物学的に重要な生体分子の特異的相互作用や、一見不要にも思える非特異的相互作用の役割を明らかにしてきました。NMR法によって明らかになる相互作用情報は、生体分子の機能を明らかにするのみならず、構造に基づくリガンドの最適化などにも役立ちます。
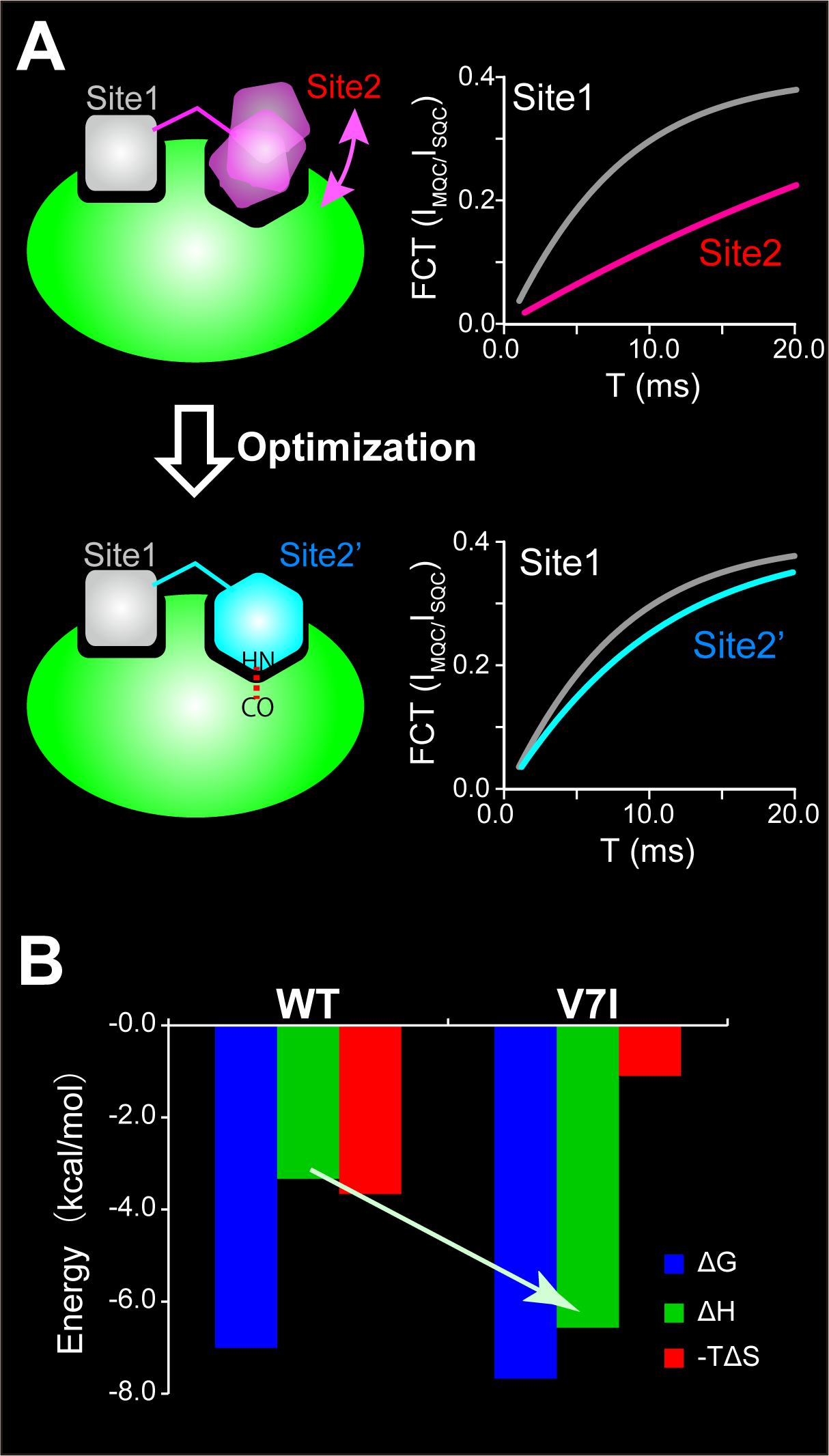
FCT法によるリガンドの動的最適化

リガンドと受容体の相互作用の熱力学的特性は、結合の特異性との関係から注目されています。 しかし、好ましい熱力学的特性を持つリガンドを設計することは、簡単ではありません。 私たちは、禁制コヒーレンス遷移(FCT)解析を用いることで、受容体と相互作用した リガンドの局所的なダイナミクスと表面の相補性を、実験的に評価し、リガンドの構造を 最適化する方法を開発しました (Panel A)。FCT法はL. Kayのグループでタンパク質の運動性解析のために開発されたものですが、我々はその応用範囲を リガンドの最適化に拡張することに成功しました (Angew. Chemie. Int. Ed., 2016; Molecules, 2017)。
FCT法をペプチドリガンドとプロテインキナーゼp38αとの相互作用に適用し、 p38α結合状態におけるリガンドのメチル基の運動性と表面相補性を定量的に 解析することで、ペプチドに合理的な構造改変を導入し、元のペプチドよりも 高い受容体親和性とエンタルピー的寄与の大きい優れた熱力学的特性を持つ リガンドを得ることができました (Panel B)。この戦略によって最適化された リガンドは、受容体に対する高い特異性を達成することができることから、 構造創薬において広く活用可能方法であると考えられます。
プロテインキナーゼの制御

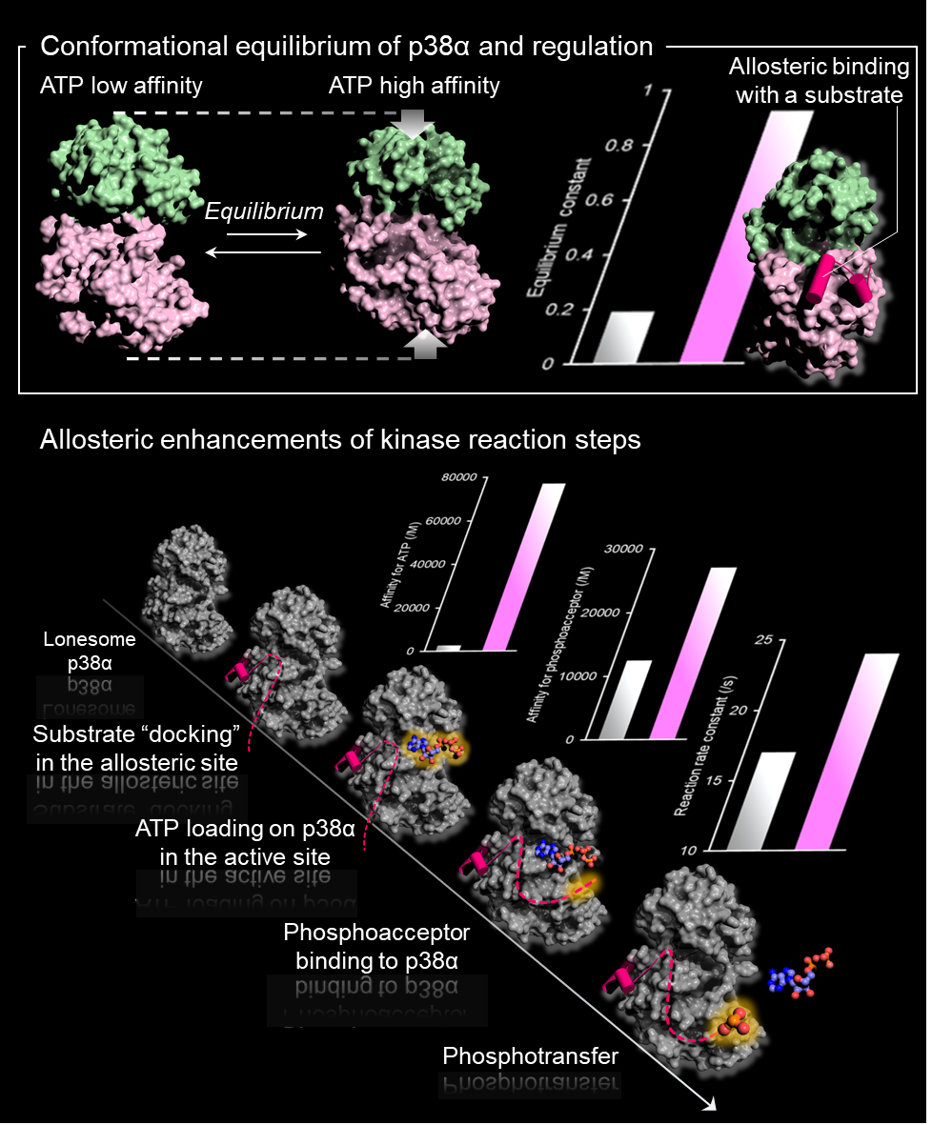
プロテインキナーゼはシグナル伝達経路や分子ネットワークにおいて基質、 上流キナーゼ、リン酸化酵素、足場タンパク質などの様々なタンパク質と相互作用しながら機能します。近年、システム生物学的なアプローチによりシグナル伝達の出力の挙動が推定・可視化されるようになりました。しかし、タンパク質の構造が本質的に動的であるために、分子間相互作用や酵素活性が様々な物理化学的要因によって調節されうることは、ほとんど考慮されていません。
私たちは、このような機構の解明には実験的にタンパク質の構造やダイナミクスを明らかにする研究が不可欠と考えています。その一環として、ストレス応答性MAPKであるp38αが、ATPに対する親和性が異なるコンフォメーション間の平衡状態にあり、特定の基質がアロステリック部位に結合するとATPに高親和性の構造が安定化し、p38αのキナーゼ活性が上昇することを見出しました。 この機構により、ATP濃度が低下するストレス環境下においても、p38αは基質を効率的にリン酸化でき、ストレスシグナル伝達が堅牢になります(Nat. Struct. Mol. Biol., 2014)。私たちは、シグナル伝達ネットワーク全体の挙動を、タンパク質構造の動的特性を考慮しながら把握することを目指した、統合的かつ包括的なアプローチの確立を目指して研究を進めています。